颅骨作为高度精密调控的组织,其发育与再生过程受严格分子调控。颅骨干细胞的命运决定及向成骨细胞谱系的定向分化,对颅骨正常发育与损伤修复至关重要。然而,颅骨干细胞如何精确调控颅骨发育与再生的分子机制,一直是科学界亟待解决的关键问题。
近日,我院陈贵钱课题组在国际权威期刊《自然-通讯》(Nature Communications,影响因子14.7)发表题为“Nf2-FAK signaling axis is critical for cranial bone ossification and regeneration”的研究成果。该研究揭示Nf2-FAK信号轴在颅骨干细胞命运决定及颅骨发育与再生中的核心调控作用。我校为第一署名单位,研究生廖军光、黄钰萍为共同第一作者,陈贵钱副教授为通讯作者。

研究团队通过高通量测序筛选新靶点,结合条件性基因敲除小鼠模型,发现Nf2基因在颅骨组织中特异性高表达。颅骨间充质干细胞中特异性敲除Nf2基因导致成骨活性显著降低,引发严重颅骨发育缺陷。通过小动物CT扫描、骨架染色及3D建模等系统分析,团队证实Nf2缺失显著影响颅骨骨量、骨形成面积及整体形态与大小,明确了Nf2基因在间充质干细胞中对颅骨发育和形态建成的决定性作用。
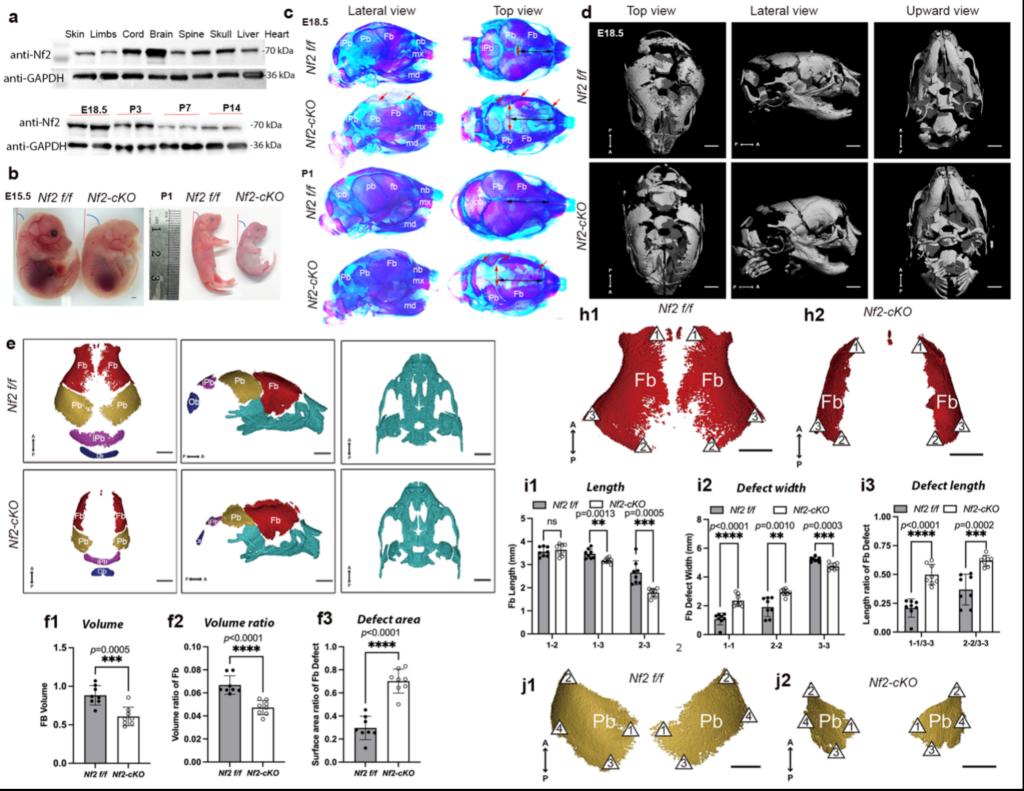
课题组研究发现,Nf2缺失的成骨细胞中FAK激酶活性显著下降。通过慢病毒过表达、CO-IP及NanoBiT活细胞蛋白互作实验,团队证实Nf2是FAK的上游调控因子,并与FAK直接互作。Nf2-FAK信号轴通过调控PI3K/Akt和Erk1/2通路发挥功能,Nf2缺失减弱了FAK与PI3K催化亚基p110的相互作用,表明Nf2-FAK是PI3K功能的上游调控模块。研究还发现,Nf2缺失不仅影响成骨细胞分化与功能,还显著抑制间充质干细胞的迁移能力和成骨细胞的粘附特性。药物干预实验表明,激活FAK及其下游信号分子(PI3K/Akt和Erk1/2)可有效修复Nf2缺失导致的成骨活性异常。此外,课题组通过构建颅骨缺损小鼠模型,结合诱导性基因敲除和R26-Tomato细胞示踪技术,发现Nf2缺失显著延迟颅骨缺损再生,并降低迁移至损伤部位的颅缝干细胞的增殖潜能。
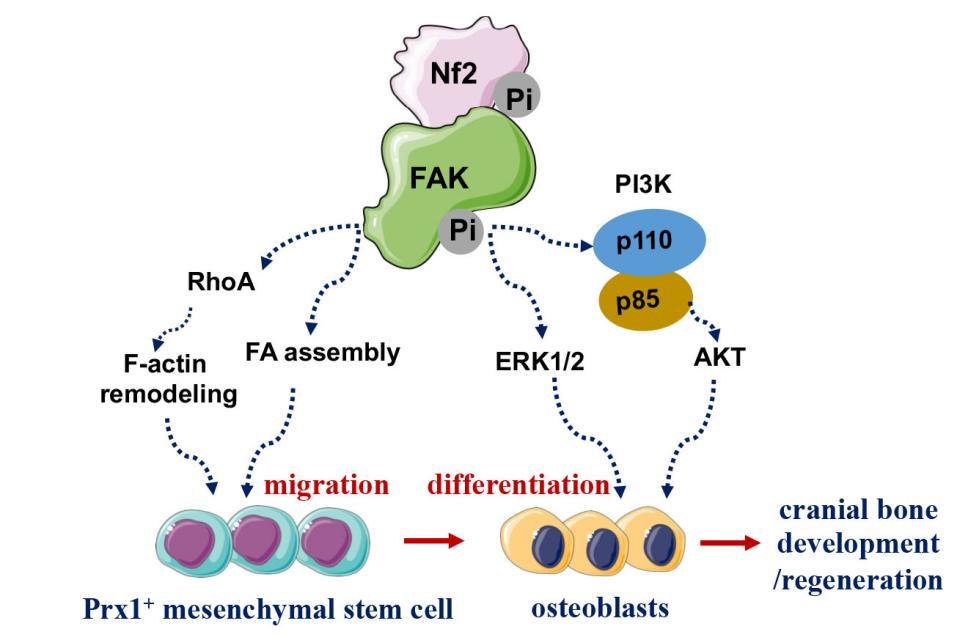
本项目系统解析了Nf2-FAK信号轴调控颅骨干细胞谱系分化、发育与再生的分子机制,深化了对FAK信号转导精细调控的理解,为基于Nf2-FAK信号轴的激活肽筛选与设计提供了科学依据。研究成果有望为颅骨缺损再生的临床干预提供新靶点和新策略,具有重要的临床转化价值。相关研究获国家自然科学基金、浙江省自然科学基金重点项目及浙江省钱江人才项目资助。
论文链接: https://www.nature.com/articles/s41467-025-57808-4
陈贵钱课题组介绍:

陈贵钱,副教授,研究生导师,浙江大学理学博士,美国阿拉巴马大学伯明翰分校联培博士,美国康奈尔大学威尔医学院及佐治亚大学博士后。浙江省海外高层次人才、杭州市D类领军人才。2018年11月加入浙江理工大学,现任校青促会副理事长,2022-2023年外派至浙江省经信厅消费品处(生物医药产业处)。研究方向为间充质干细胞/神经嵴细胞与骨生物学,聚焦干细胞命运决定、骨代谢与再生机理及出生缺陷诊疗技术。主持国自然、省重点等多项课题,以第一/通讯作者在Nat Commun等期刊发表SCI论文20余篇,ESI高被引2篇,总引4700余次,获授权发明专利2项。曾获校科技突出贡献奖、教学成果二等奖等荣誉,指导学生获全国挑战杯一等奖等荣誉。
供稿人:陈贵钱
