神经嵴细胞作为具有多向分化潜能的干细胞,在胚胎发育过程中可分化为神经、骨骼、软骨等多种细胞类型,对颅面器官(如额骨、颌骨)的形成至关重要。这些细胞的分化过程受到精确调控,一旦出现异常,就会导致唇腭裂、颅缝早闭等先天性畸形。然而,神经嵴细胞如何在复杂微环境中接收并整合多种信号、进而实现精准的定向分化这一分子调控机制,仍是发育生物学与再生医学交叉领域中亟待解决的重要科学问题。
近日,陈贵钱课题组在临床医学国际知名期刊《JCI Insight》发表题为“Nf2/FGFR1/AKT axis directs cranial neural crest-derived skull morphogenesis via collagen synthesis and trafficking”的研究成果,该研究揭示了Nf2通过FGFR-AKT信号轴精确调控胶原蛋白合成与分泌的分子机制,解析了这一通路在神经嵴细胞谱系定向分化和颅骨发育中的核心作用。我校为该研究的第一署名单位,研究生黄钰萍为本文第一作者,陈贵钱副教授为最后通讯作者。

论文链接:https://insight.jci.org/articles/view/191112
研究团队通过构建神经嵴细胞特异的Nf2条件性基因敲除小鼠模型(Nf2-cKO),结合组织形态学和神经嵴细胞原代培养等技术体系,发现Nf2基因在颅骨发育中的双重调控功能:一方面通过细胞自主性方式调控神经嵴源额骨矿化,另一方面以非细胞自主性方式影响中胚层源顶骨形成。这一发现证实Nf2在颅骨发育过程中具有自分泌和旁分泌双重功能,为理解颅颌面复杂器官发育中组织间互作提供了新的分子视角。
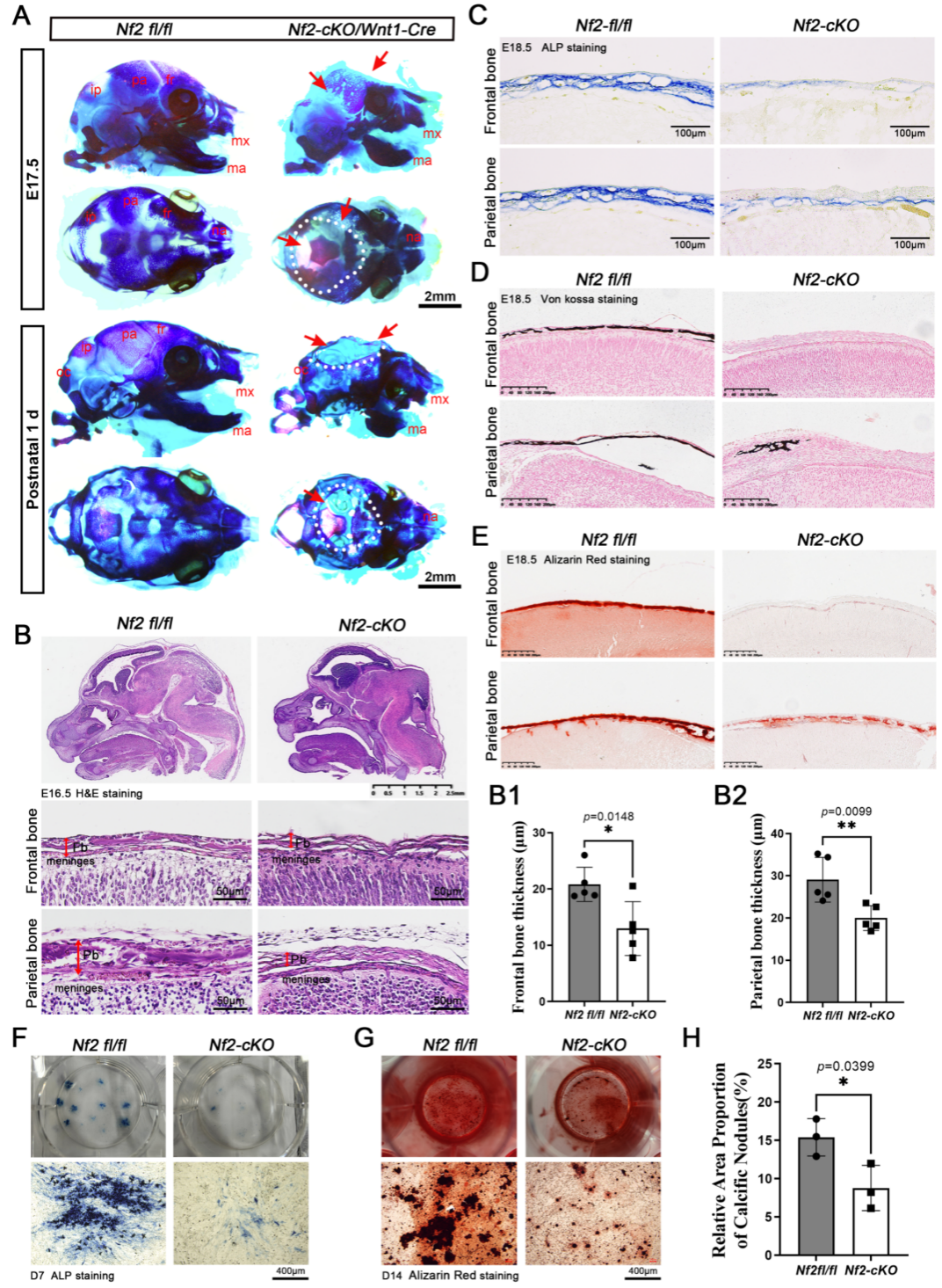
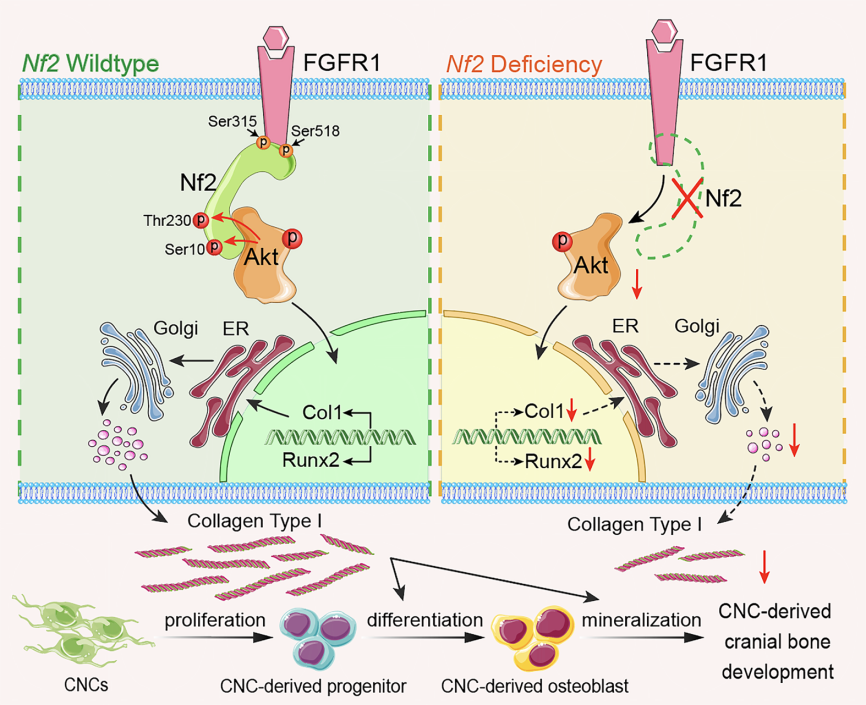
研究团队通过细胞生物学及分子互作等技术证实,Nf2作为衔接蛋白特异性结合FGFR1与AKT形成三元复合物。Nf2缺失虽不影响FGFR1自身活性,但会导致下游AKT磷酸化水平显著降低。值得注意的是,Nf2缺失的神经嵴成骨细胞出现典型的胶原代谢紊乱,表现为I型胶原合成显著减少、纤维组装异常和囊泡分泌障碍。通过药物干预恢复AKT活性可有效逆转胶原合成-分泌失衡,确证Nf2是通过FGFR1-AKT轴调控胶原代谢稳态的核心枢纽。
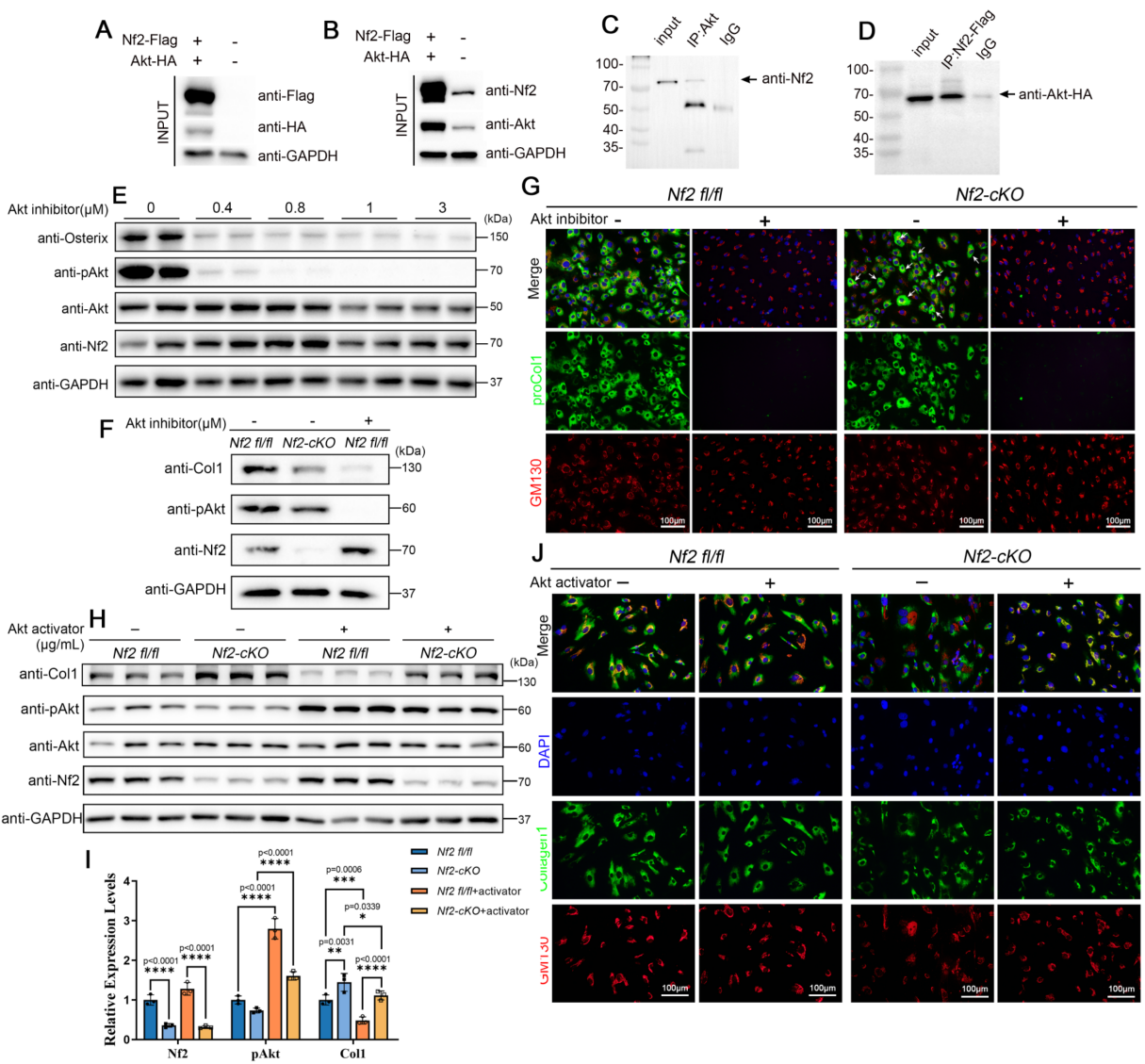
研究团队进一步揭示了Nf2蛋白通过其特异的Ser10和Thr230磷酸化位点精确调控FGFR1与AKT相互作用的机制,其中Thr230位点的突变可选择性破坏AKT结合而不影响FGFR1关联,而磷酸化模拟突变体Nf2(T230D)能逆转Nf2缺失导致的成骨缺陷,证实了AKT活性与Nf2磷酸化水平之间存在正反馈调节关系。这些发现不仅从分子结构层面阐明了Nf2在神经嵴颅面发育中的关键调控机制,更为重要的是,针对Thr230位点的精准干预策略为治疗相关先天畸形提供了新的治疗靶点,具有重要的临床应用前景。本研究得到国家自然科学基金和浙江省自然科学基金重点项目等资助。
陈贵钱课题组介绍:

陈贵钱,副教授、研究生导师,浙江大学理学博士/美国阿拉巴马大学伯明翰分校联培博士,美国康奈尔大学威尔医学院及佐治亚大学博士后。2018年11月加入浙江理工大学,2022-2023年科技外派至省经信厅(生物医药产业处),现任校青促会副理事长。主要研究间充质干细胞与器官发育和再生。聚焦干细胞命运调控、骨发育与再生机理、骨代谢与疾病发生机制以及出生缺陷分子诊疗技术。主持国家自然科学基金面上项目、省自然科学基金重点项目等多项课题,以第一/通讯作者在Nature Communications、Cell Reports、JCI insight等期刊发表SCI论文30余篇(ESI高被引2篇),总他引5200余次,申请发明专利6项(授权2项/转化2项),指导本科生荣获全国挑战杯一等奖、发明创新成果二等奖等荣誉。

第一作者简介:黄钰萍,浙江理工大学生命科学与医药学院2021级硕士研究生,研究方向为神经嵴细胞与骨发育。以第一/共一作者在Nature Communications、JCI insight、Cellular Molecular Life Sciences和Cellular Signaling发表SCI论文4篇。在读期间连续三年获校级一等奖学金(2021-2023),荣获2024届浙江省普通高等学校优秀毕业生荣誉称号。
